¿Qué son los modelos atómicos?
Un modelo atómico es una representación teórica que describe la estructura y el comportamiento del átomo. A lo largo de la historia, estos modelos han evolucionado para explicar los resultados experimentales y las observaciones científicas de la época.
Los modelos atómicos intentan explicar cómo están organizados los electrones, protones y neutrones dentro del átomo, así como cómo interactúan entre sí y con otros átomos. Estos modelos son fundamentales para comprender la naturaleza de la materia y son la base de muchas áreas de la ciencia, como la química, la física y la medicina.
Cada modelo atómico representa una etapa en la evolución del conocimiento humano sobre la estructura atómica y está basado en la tecnología y el entendimiento científico de su época. Los modelos más antiguos, aunque incorrectos en términos de la ciencia moderna, fueron importantes en su momento para desarrollar una comprensión más profunda de la estructura atómica. Los modelos más recientes incorporan la mecánica cuántica y proporcionan una descripción más precisa y completa de los átomos y sus interacciones.
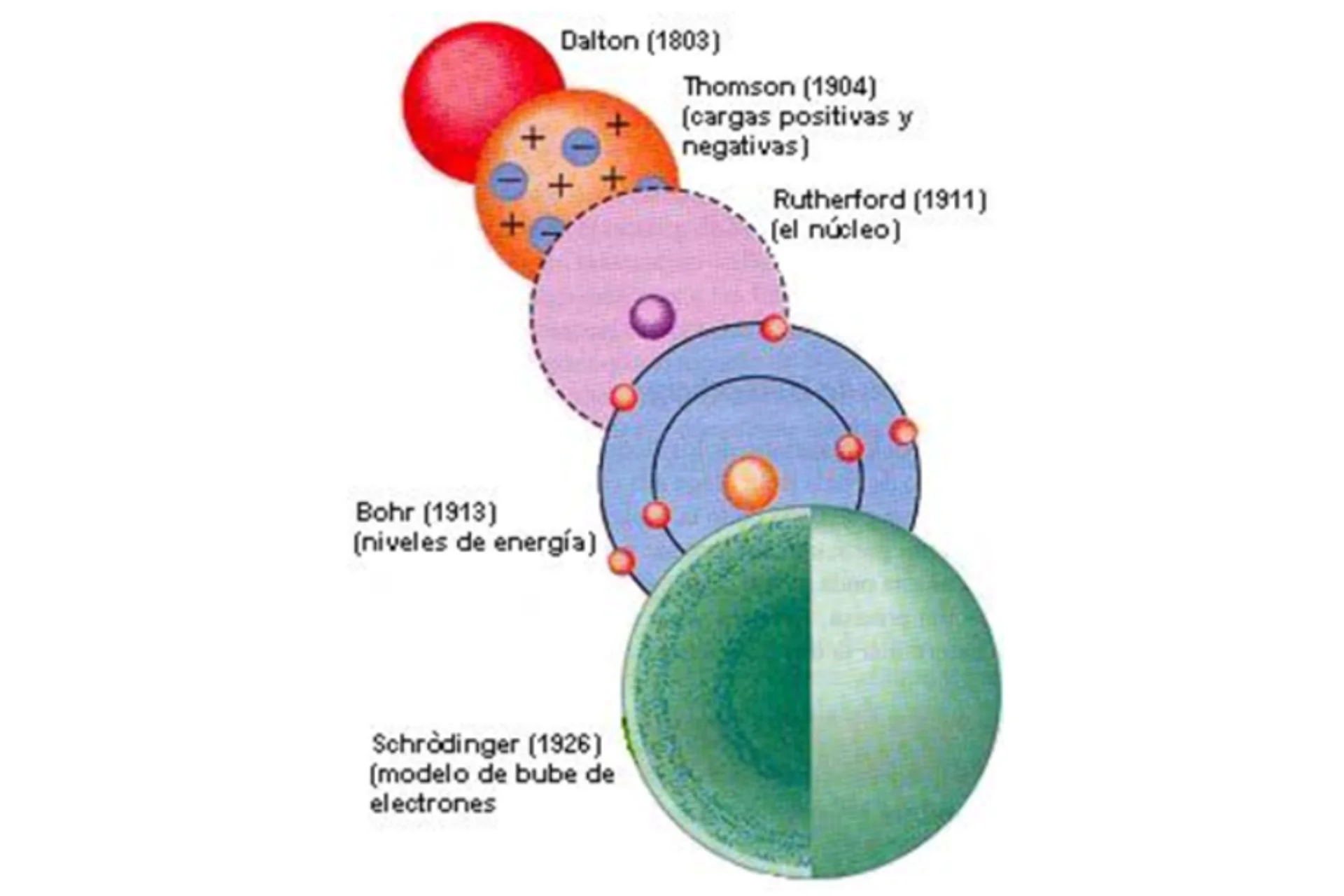
Cronología de los modelos atómicos
- Modelo de Dalton (1803)
- Modelo de Thomson (1904)
- Modelo de Rutherford (1911)
- Modelo de Bohr (1913)
- Modelo de Schrödinger (1926)
- Modelo de la Mecánica Cuántica (Actual)
¿Cuáles son los modelos atómicos?
Por supuesto, aquí tienes una descripción más detallada de cada modelo atómico:
Modelo de Dalton
-
- Descripción. Propuesto por John Dalton, este modelo considera los átomos como partículas indivisibles e indestructibles, diferentes para cada elemento. Los átomos del mismo elemento tienen la misma masa y propiedades químicas.
- Limitaciones. No explicaba la estructura interna del átomo ni la existencia de partículas subatómicas como electrones, protones y neutrones.
Modelo de Thomson
-
- Descripción. J.J. Thomson propuso que los átomos eran una esfera uniforme de materia cargada positivamente, con electrones incrustados como «pasas en un pastel.» Este modelo fue una respuesta al descubrimiento del electrón.
- Limitaciones. No explicaba cómo los electrones estaban organizados dentro del átomo, y no tenía en cuenta la existencia de un núcleo central cargado positivamente.
Modelo de Rutherford
-
- Descripción. Después de realizar un experimento de dispersión de partículas alfa, Ernest Rutherford concluyó que el átomo tenía un núcleo denso y cargado positivamente, con electrones orbitando en el espacio circundante. La mayor parte del átomo era espacio vacío.
- Limitaciones. El modelo no explicaba por qué los electrones no caían en el núcleo debido a la atracción electromagnética ni cómo estaban organizados en órbitas definidas.
Modelo de Bohr
-
- Descripción. Niels Bohr propuso que los electrones orbitaban en niveles de energía fijos y cuantizados alrededor del núcleo. Los electrones podían saltar entre estos niveles, absorbiendo o emitiendo energía en forma de fotones.
- Limitaciones. El modelo tenía éxito en explicar el espectro de hidrógeno pero fallaba en predecir el comportamiento de átomos con más de un electrón. No coincidía con los principios de la mecánica cuántica.
Modelo de Schrödinger
-
- Descripción. Erwin Schrödinger desarrolló una ecuación de onda que describía cómo los electrones se comportaban como ondas. En lugar de órbitas definidas, los electrones estaban en regiones de probabilidad llamadas orbitales.
- Limitaciones. Aunque era un avance significativo, aún había dificultades en describir algunos fenómenos atómicos y moleculares, especialmente en sistemas complejos.
Modelo de la Mecánica Cuántica
-
- Descripción. Este modelo utiliza la teoría cuántica de campos y el principio de incertidumbre de Heisenberg. Los electrones se describen mediante funciones de onda, y su posición y momento no se pueden conocer con precisión al mismo tiempo.
- Limitaciones. Aunque es el modelo más preciso hasta ahora, su interpretación y aplicación pueden ser complejas. La mecánica cuántica a menudo se describe como contraintuitiva y su interpretación exacta aún es objeto de debate.
Si quieres saber más sobre Química, visita nuestros apuntes gratuitos para Bachillerato y Selectividad.





13 comentarios en «Resumen de los Modelos Atómicos»
Un cordial saludo. Con respecto a las discusiones ontológicas sobre la mecánica Cuántica, quisiera colegiar una «Demostración» de la cual se deduce que: «la unidad de medida de la Constante de Planck que conocemos («Acción») adolece de un término, el cual al ser adicionado permite descifrar de manera explícita el verdadero significado físico de esta Constante, y la solución de la paradojas asociadas con la Mecánica Cuántica»!
Me encantó ese resumen
Muchas gracias 🙂
Gracias
De nada 🙂
Excelente
Muy buena la explicación me sirvió para la investigación de mi tarea la recomiendo
Gracias 🙂
El lunes tengo una exposición grupal sobre todo esto, y esto me a sido de mucha ayuda, ahora la tengo fácil, ¡muchísimas gracias por la información!
Muchas gracias y espero que te haya salido bien.
me ayudó mucho la información, explican de manera correcta , breve y concreta , lo que hace mucho más fácil al lector comprender el tema
Buena información
¡Gracias!